瓊脂糖凝膠電泳后的 DNA 條帶異常現(xiàn)象
你是否在 DNA 電泳后遇到過這種現(xiàn)象呢?
DNA Marker 或樣品的某些條帶呈笑臉型、W 型、亮度異常,多條條帶堆疊在一起、無法區(qū)分開,或者出現(xiàn)拖尾現(xiàn)象
這些都會影響 Marker 的功能,使樣品的條帶大小和濃度難以準(zhǔn)確預(yù)估
技術(shù)背景
核酸電泳是進(jìn)行核酸研究的重要手段,是核酸探針、核酸擴(kuò)增和序列分析等技術(shù)所不可或缺的組成部分。
溴化乙錠(EB)由于價(jià)格便宜,常用于瓊脂糖和 PAGE 凝膠中的核酸染色。但 EB 是強(qiáng)致癌誘變劑,由于其分子量較小,極易滲透細(xì)胞膜與胞內(nèi) DNA 分子嵌合,進(jìn)而影響 DNA 的復(fù)制,破壞正常的遺傳生理現(xiàn)象。
鑒于此,很多廠家研發(fā)了大分子的新型核酸染料,新型核酸染料由于分子較大,更難進(jìn)入細(xì)胞,所以安全性更高。而且靈敏度更高,比如 GelRed 大約是 EB 的 4~5 倍。
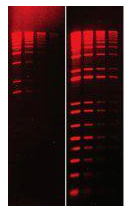
EB 與 GelRed 靈敏度對比
但也正是新型染料分子較大,會影響 DNA 分子在電泳時(shí)的遷移,所以 DNA 條帶在電泳中可能發(fā)生扭曲、變形、拖尾現(xiàn)象。
核酸染料結(jié)合 DNA 后改變了 DNA 的空間結(jié)構(gòu),使原本帶負(fù)電荷的電量減少,DNA 分子增大。
這一系列改變使得 DNA 分子在瓊脂糖凝膠電泳中的相互作用力改變,運(yùn)動特點(diǎn)和未結(jié)合核酸染料的 DNA 分子也有所不同,這些因素共同導(dǎo)致 DNA 分子的形態(tài)在運(yùn)動中發(fā)生了改變。特別是對大分子量的 Marker,可能導(dǎo)致 Marker 條帶變形、分不開的現(xiàn)象。
根據(jù)核酸染色和電泳的先后順序,核酸電泳一般可分為預(yù)染法(前染法)和泡染法(后染法)兩種方法, 在凝膠中添加染料稱為預(yù)染法,電泳完成之后再進(jìn)行染色稱為泡染法。
我們實(shí)驗(yàn)中經(jīng)常用到的就是預(yù)染法,但預(yù)染法在電泳中可能遇到上述的一些問題,而由于泡染法是電泳后再染色,可有效避免上述現(xiàn)象的產(chǎn)生。
實(shí)驗(yàn)案例
下面,以我們東盛生物的新型核酸染料 DSRed(貨號:M7021)和 22 種 DNA Marker 為實(shí)驗(yàn)材料,做一個(gè)預(yù)染法與泡染法中核酸染料對DNA條帶形態(tài)影響的驗(yàn)證:
我們選擇了不同大小的 Marker 并對其分類,分別用 1%、1.7%、3% 濃度的凝膠進(jìn)行了預(yù)染法和泡染法電泳對比。
以下左圖為預(yù)染結(jié)果,右圖為泡染結(jié)果:

Figure.1 適合 1% 凝膠濃度的 DNA Marker(大片段較多)的預(yù)染/泡染對比(1)
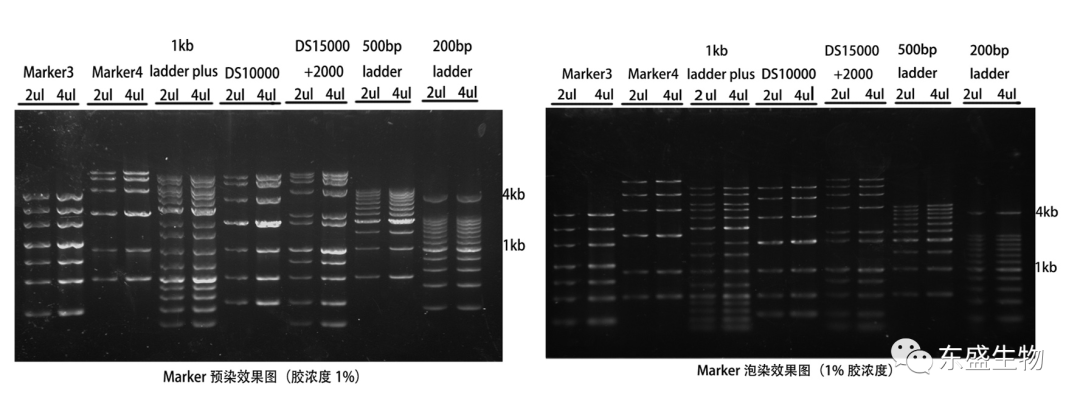
Figure.2 適合 1% 凝膠濃度的 DNA Marker(大片段較多)的預(yù)染/泡染對比(2)

Figure.3 適合 1.7% 凝膠濃度的 DNA Marker(片段大小適中)的預(yù)染/泡染對比
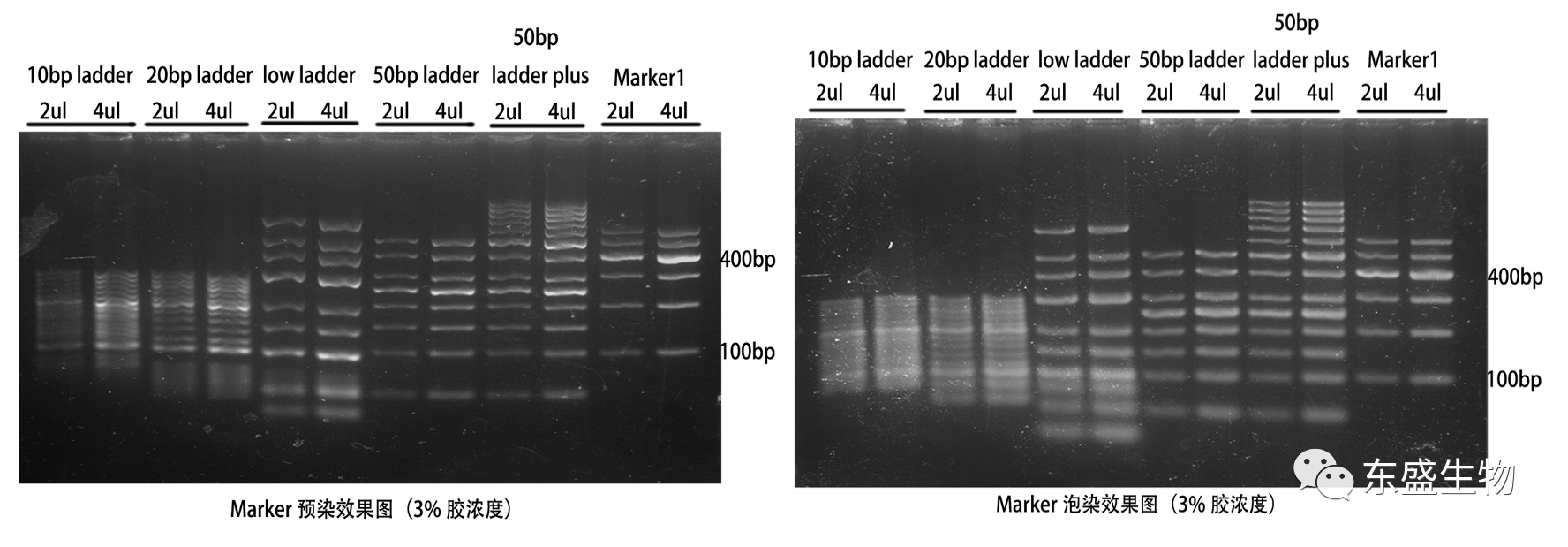
Figure.4 適合 3% 凝膠濃度的 DNA Marker(小片段較多)的預(yù)染/泡染對比
結(jié)果分析:
從 fig.1 到 fig.4 的整體對比中可以清晰的看出,Marker 在預(yù)染膠中的條帶會發(fā)生彎曲成「W」型,且條帶大小越大,彎曲越明顯;而在泡染膠中,電泳時(shí)沒有染料的影響,條帶基本正常。
從 fig.1、fig.2 的兩種方法的對比中可以看出,在預(yù)染膠中,5kb 及以上的大分子 DNA 條帶更容易會出現(xiàn)變形、分不開的現(xiàn)象,而在泡染膠中 Marker 條帶是清晰分開的。
此外,DNA 的濃度也是需要考慮的因素,濃度越高,則結(jié)合的染料分子越多,遷移阻力也越大,同樣更容易出現(xiàn)條帶變形或分不開的問題。
總結(jié)
由于新型核酸染料會影響 DNA 分子在電泳時(shí)的遷移,特別是大分子的核酸,所以,如果在實(shí)驗(yàn)中用到大分子量的 DNA Marker 或者用預(yù)染法電泳時(shí) Marker 條帶出現(xiàn)彎曲、分不開的現(xiàn)象,建議使用泡染法進(jìn)行染色。
此外,使用新型染料預(yù)染時(shí)一定要注意 Marker 及樣品用量。由于不同 Marker 的濃度不一樣,因此可以做幾個(gè)梯度進(jìn)行加樣,選擇較合適的用量。也可以用 1X 上樣緩沖液對 Marker 進(jìn)行不同倍數(shù)稀釋后使用,可以更有效地改善條帶異常的問題。不過只有使用后染法才能真正避免染料對核酸遷移的影響。
延伸問題:
Q1: 為什么同時(shí)電泳的樣品 DNA 條帶正常?
A: 因?yàn)闃悠吠菃我粭l帶,或條帶數(shù)量比較少,沒有 Marker 那么多,那么就不容易產(chǎn)生條帶間的擠壓,所以看起來是比較正常的。但是大片段或高濃度片段會結(jié)合較多的染料,因此遷移速率依然會降低,所以也要注意樣品用量。必要時(shí)建議采用后染法進(jìn)行染色。
Q2: 為什么上面的預(yù)染實(shí)驗(yàn)結(jié)果沒有出現(xiàn)條帶劇烈變形、堆積、亮度很高的情況?
A: 因?yàn)閲?yán)格按照使用建議添加了適量的染料,使其終濃度為 1X,而不是隨意添加一些使其過量,那樣非常容易加重 DNA 條帶異常的情況。
后染法真的很麻煩嗎?
后染并不麻煩,而且配制的染色液可以多次使用,缺點(diǎn)是比前染法稍微耗費(fèi)染料、染色時(shí)間長(20~30 min)、靈敏度略低一些。
但是 5kb 及以上片段較多、濃度較高的 Marker 或樣品,如果前染的結(jié)果已經(jīng)如本文開頭那樣差了,那么建議還是用后染法得到一張清晰好看的電泳圖。
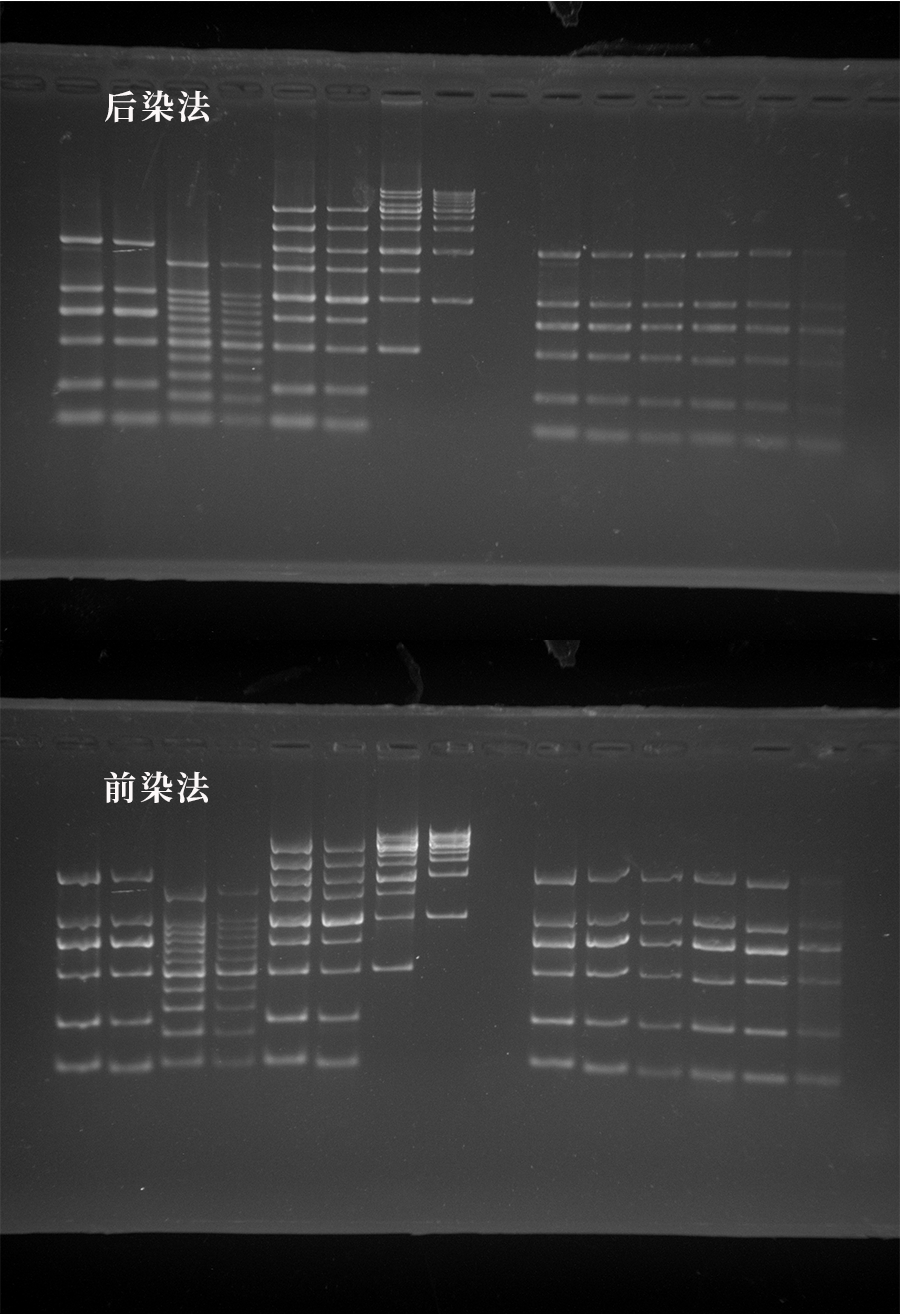
后染法與前染法效果對比
含有 5kb 及以上的 DNA 片段建議采用后染法
|